【研究背景&研究內容】
(研究背景) Mn2+離子在促進cGAS-STING通路激活中起着至關重要的作用。這些離子可以自由穿透細胞膜,增加cGAS對雙鏈DNA的親和力,進一步激活STING通路,從而刺激樹突細胞的成熟,增強腫瘤特異性T細胞反應。此外,Mn2+離子可以通過芬頓樣反應誘導細胞凋亡,併產生有毒羥基自由基,這會放大氧化應激,促進有效的免疫原性細胞死亡效應。然而,遊離的Mn2+離子可以從注射部位迅速進入循環系統並被迅速消除。有效遞送Mn2+離子對於最大限度地發揮免疫敏感功能至關重要。
近年來,研究人員通過利用分子工程和納米生物技術策略引入外源錳離子進行免疫激活和腫瘤消除。代表性載體包括響應性Mn基納米激動劑,如Mn層狀雙氫氧化物納米顆粒、Mn納米纖維水凝膠、Mn脂質納米複合材料和Mn聚合物納米材料。然而,Mn2+免疫激動劑作爲免疫療法的臨牀開發面臨挑戰,包括(i)由於納米顆粒的停留時間短(不到2天),需要頻繁靜脈注射,(ii)與非靶向全身給藥相關的不良毒性和免疫抑制作用,以及(iii)某些實體瘤部位的可及性有限。
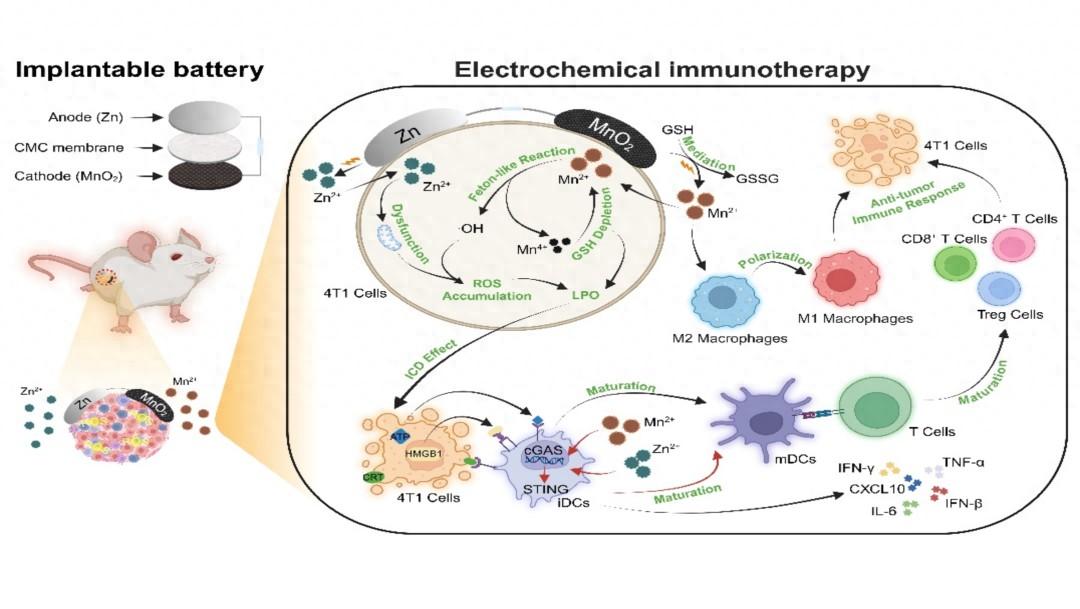
(研究內容) 鑑於此,吉林大學盧革宇/賈曉騰團隊提出了一種可植入的腫瘤微環境(TME)激活的Zn//MnO2電池。該電池利用體液作爲電解質,氧化還原活性物質作爲介質,能夠持續局部輸送金屬離子去調控TME和激活免疫系統。這種方法延長了電池壽命,並提供了電化學界面之外的額外電荷轉移路徑。與未連接的電池(即處於開路狀態)相比,電池放電通過Mn2+和固體MnO2之間的有效雙電子轉移轉換以及內源性谷胱甘肽的消耗,促進了Mn離子的更大局部生成。在GSH耗竭的幫助下,氧化應激失衡是通過Mn2+誘導的Fenton樣反應和Zn2+誘導的線粒體積累來實現的。所有這些產物都有助於腫瘤細胞發生免疫原性死亡,刺激cGAS-STING通路,激活樹突狀細胞,增加T淋巴細胞浸潤,逆轉免疫抑制微環境(從M2巨噬細胞轉變爲M1巨噬細胞)。這最終導致了良好的抗腫瘤效果,最終實現了99.6%的腫瘤生長抑制率。其成果以題爲“Tumor
microenvironment-activated Zn//MnO2 battery for sustained and local electrochemical immunotherapy”在國際知名期刊Science Advances上發表。
【研究亮點】
⭐腫瘤微環境(TME)激活的電化學反應,具有癌細胞靶向性:使用磷酸鹽緩衝液(PB,pH = 7.4)模擬正常組織條件和PB(pH = 6.8)與GSH(100 μM)模擬腫瘤條件的電化學。在PB電解質(pH = 7.4)中沒有明顯的氧化還原峯。相比之下,在含GSH的PB電解質中觀察到兩個氧化還原峯,這歸因於固體MnO2的還原和GSH/GSSG的氧化還原介導,證明該電池具有TME激活的電化學反應。細胞毒性實驗也佐證了電池具有良好的癌細胞靶向性,而對正常細胞的殺傷作用均小於20%。
⭐內源GSH供電池長效運作,原位遞送大量金屬離子:TME中存在大量谷胱甘肽(GSH),在電池放電過程中GSH介體由於與MnO2/Mn2+相比較低的氧化還原電位而還原固體MnO2。這種自發的化學過程賦予電池耗盡GSH的能力,同時提供額外的氧化還原能力。隨後,氧化型谷胱甘肽(GSSG)在電極上接受電子,將其轉化爲GSH並完成介導循環。同時,在TME的陰極處建立了一個由可溶性Mn2+和固體MnO2組成的循環迴路,該回路由雙電子反應促進,去原位產生大量Mn離子。Zn離子的產生由化學腐蝕和電化學放電介導。
⭐電化學調控免疫原性細胞死亡、激活天然免疫、抑制腫瘤生長:Zn//MnO2電池誘導了通過多種機制介導的強效抗腫瘤免疫反應。一方面,該電池通過促進樹突狀細胞成熟、CD8細胞毒性T細胞分泌和CD4輔助T細胞分泌,有效地產生了協同免疫激活。另一方面,它通過明顯降低Tregs的比例和極化M2巨噬細胞與M1巨噬細胞,釋放級聯適應性免疫反應,緩解了TME的免疫抑制。這創造了一種免疫支持性TME,增強免疫細胞的持久反應並抑制腫瘤生長。
【圖文導讀】
圖1. 腫瘤微環境激活的Zn//MnO2電池在大氣環境中的電化學特性。
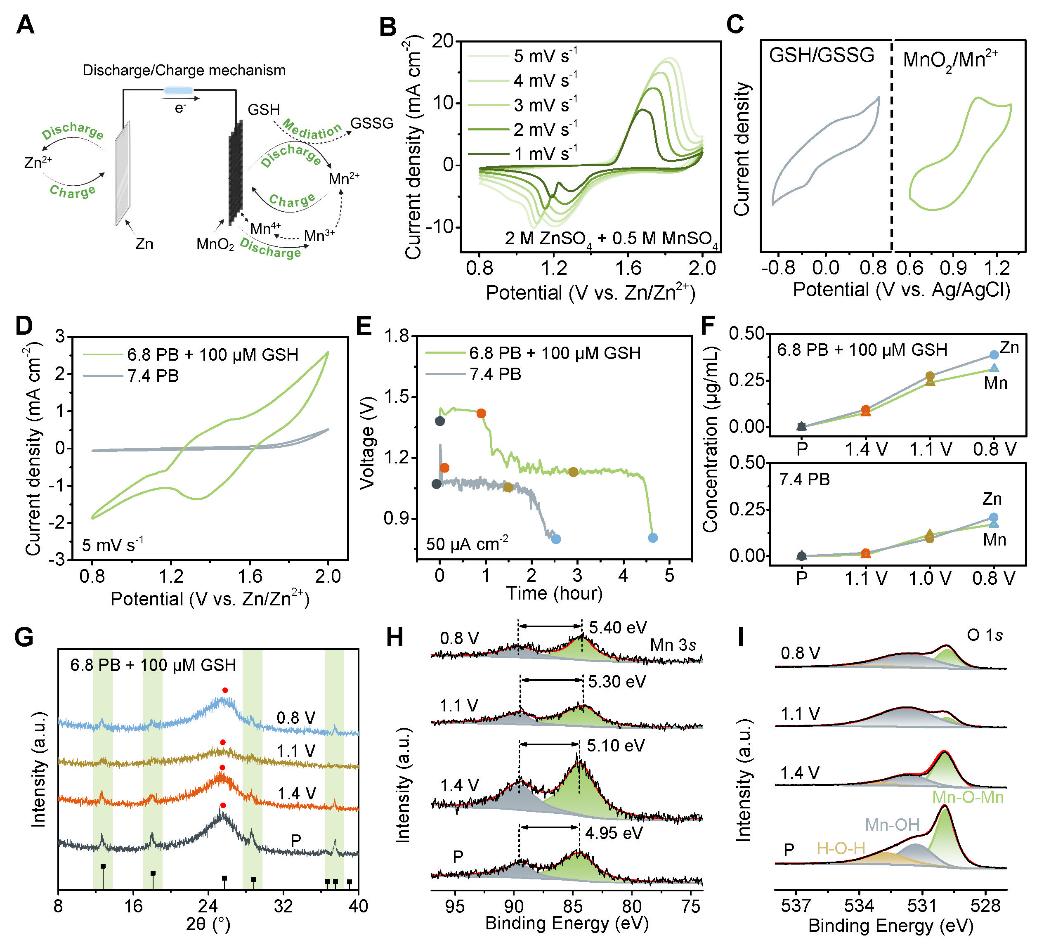
(A)電池儲能機構示意圖。(B)在2 M ZnSO4和0.5 M MnSO4中不同掃描速率下的CV曲線。(C)在5 mV s-1下,電池在100 μM GSH + 6.8 PB(左)或0.5 M MnSO4(右)電解質中的CV曲線。在PB(pH = 7.4)或含GSH的PB(pH = 6.8)電解質下,Zn//MnO2電池的(D)CV和(E)恆電流放電曲線。(F)在不同放電階段測量的電解質中的Mn和Zn濃度。不同放電時間下,MnO2陰極在含GSH的PB(pH = 6.8)中的(G)XRD圖譜,以及(H)Mn 3s和(I)O 1s的XPS圖譜。
腫瘤微環境(TME)活化電池由金屬鋅箔陽極和α-二氧化錳(α-MnO2)陰極組成,兩者都表現出優異的生物相容性。當這種電池植入小鼠皮下區域時,它使用體液作爲電解質,並利用TME中的谷胱甘肽(GSH)作爲電極和反應物之間的電子穿梭,從而提高放電容量並延長電池壽命。在放電過程中,由於與MnO2/Mn2+相比氧化還原電位較低,GSH介體還原了固體MnO2。這種自發的化學過程賦予電池耗盡GSH的能力,同時提供額外的氧化還原能力。隨後,氧化型谷胱甘肽(GSSG)在電極上接受電子,將其轉化爲GSH並完成介導循環。同時,在TME的陰極處建立了一個由可溶性Mn2+和固體MnO2組成的循環迴路,該回路由雙電子反應促進。總的來說,這些發現提供了令人信服的證據,表明Zn//MnO2電池可以在TME中激活,從而在放電過程中長時間持續產生Zn和Mn離子。
陽極:Zn – 2 e- → Zn2+ (1)
陰極:MnO2 + 2 GSH + 2 H+ → GSSG + Mn2+ + 2 H2O (2)
MnO2 + e- + 4 H+ → Mn3+ + 2 H2O (3)
MnO2 + 2 e- + 4 H+ → Mn2+ + 2 H2O (4)
圖2. 電池介導的4T1細胞微環境調節。
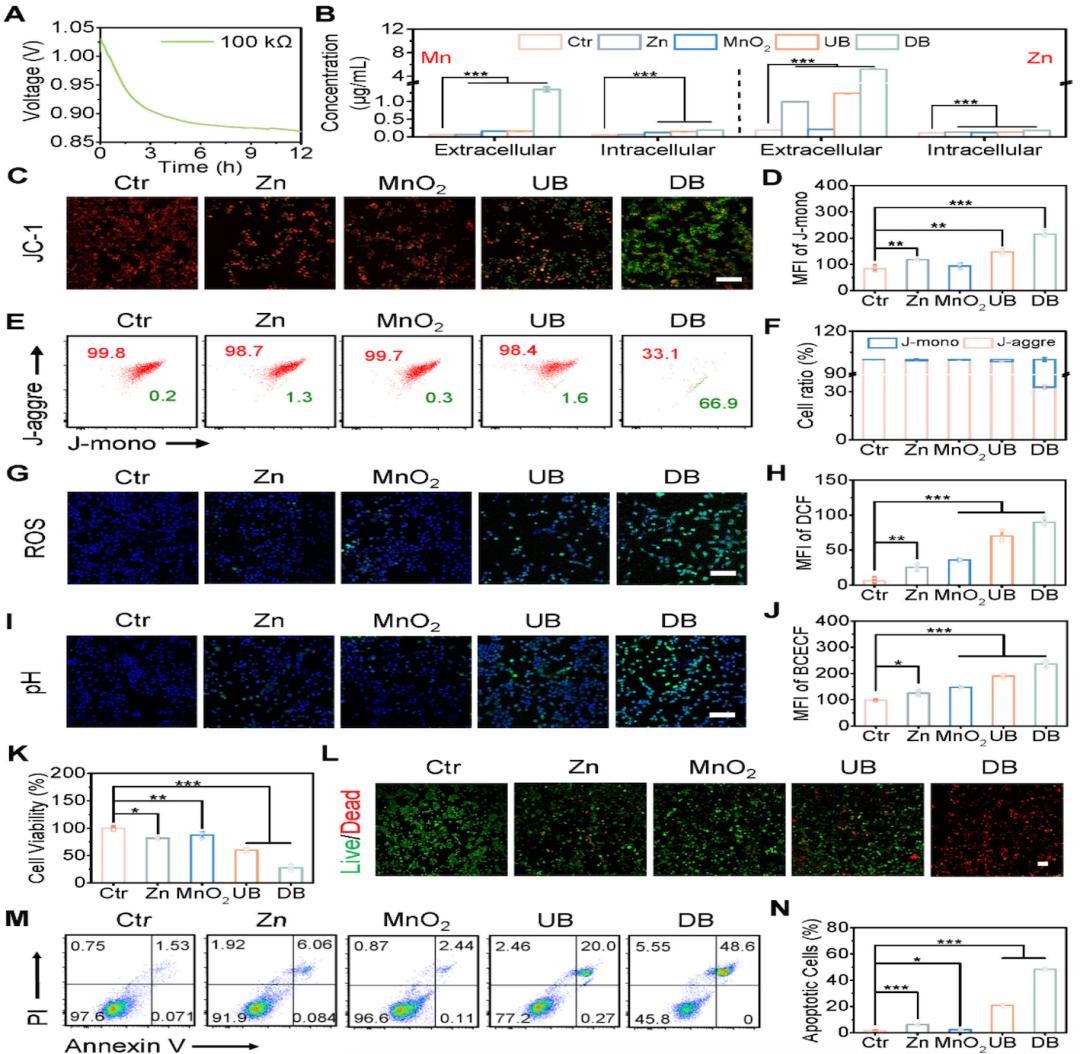
(A)Zn//MnO2電池在DMEM介質中的放電曲線。(B)Zn和Mn離子的細胞外和細胞內濃度。(C)使用JC-1探針的ΔΨm熒光圖像。(D)JC-1單體表達的定量分析。線粒體電位的(E)FCM圖和(F)對應定量分析。ROS的(G)代表性共聚焦圖像和(H)定量熒光強度。細胞滲透pH變化的(I)熒光圖像和(J)相應定量強度。
考慮到腫瘤生存的基本條件,調節TME在抑制癌症生長方面顯示出巨大的潛力。Zn//MnO2電池通過放電和化學反應(H+和GSH)調節TME,產生金屬離子(Zn2+、Mn2+、Mn3+)。首先,細胞中鋅離子的過度積累會破壞線粒體功能。這會導致電子從電子傳輸鏈泄漏,並增加ROS水平。過量的ROS會損害線粒體膜脂質、蛋白質和DNA,損害結構完整性,最終導致線粒體膜電位的喪失。其次,Mn2+可以與H2O2發生芬頓樣反應,產生·OH、OH-和Mn4+。這一過程導致ROS含量增加,微環境pH值升高。值得注意的是,ROS的積累以及Mn4+的減少導致GSH水平降低。Mn3+的水解進一步降低了微環境的酸度。此外,放電電流促進H2O2轉化爲·OH,進一步增加ROS水平。
2 Mn3+ → Mn2+ + Mn4+ (5)
Mn4+ + 2 H2O → MnO2 + 4 H+ (6)
Mn2+ + H2O2 → Mn4+ + OH- + ·OH (7)
圖3. 電池在4T1乳腺腫瘤模型中的抗腫瘤治療作用。
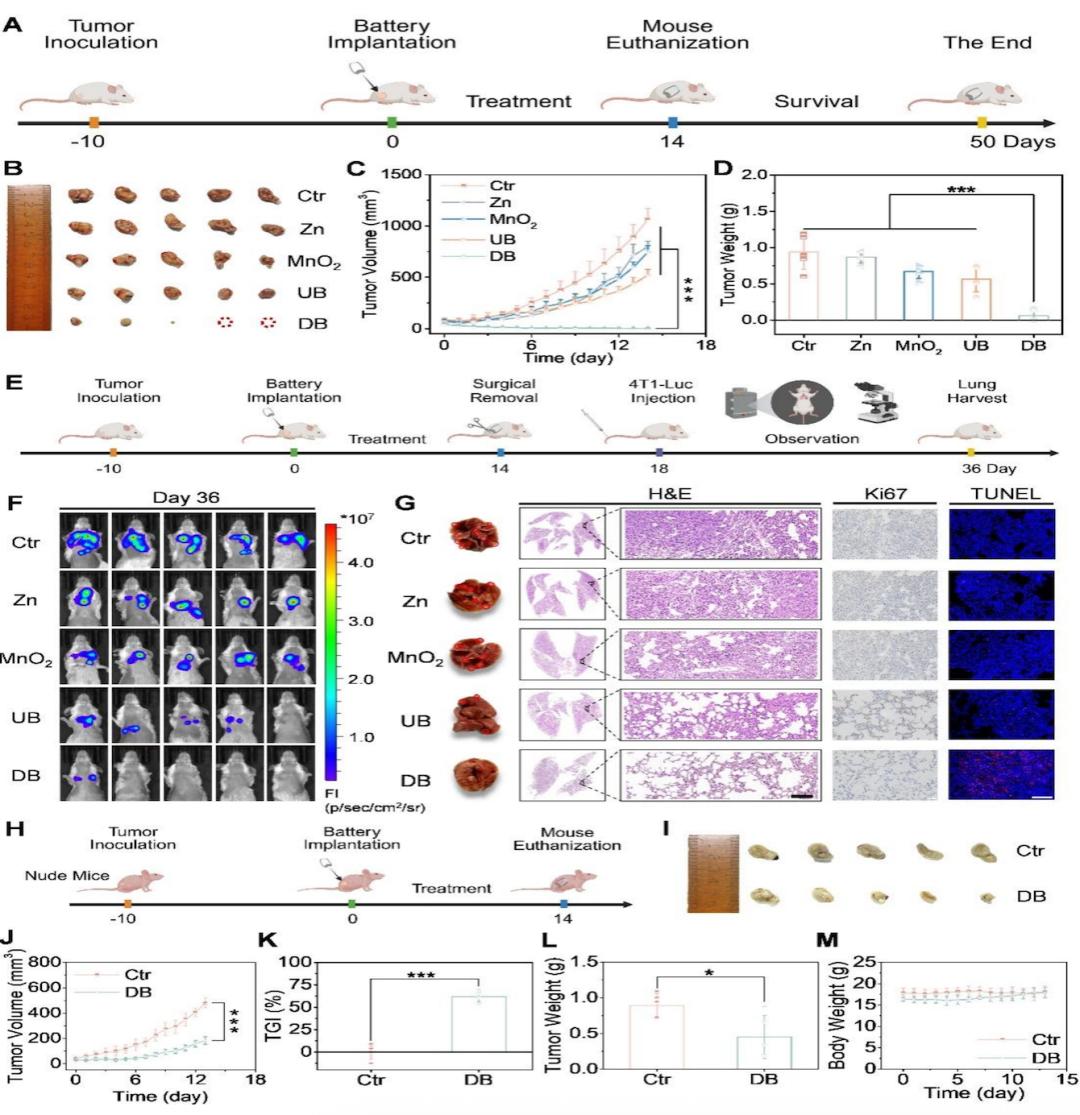
(A)電池介導的腫瘤治療過程示意圖。(B)腫瘤組織的代表性照片。(C)平均腫瘤生長曲線。(D)腫瘤重量曲線。(E)電池介導治療肺轉移的示意圖。(F)小鼠的活體生物發光成像信號。(G)第36天代表性肺的數碼照片、體外H&E染色、Ki67染色和TUNEL染色。
使用4T1三陰性癌症乳腺癌模型研究了體內抗腫瘤效果,該模型具有攻擊性,免疫原性差,並自發轉移到遠處器官。與其他實驗組形成鮮明對比的是,DB組取得了優異的抗腫瘤療效,顯著抑制了腫瘤生長,腫瘤抑制率高達99.6%,表明DB組具有優異的抗腫瘤作用。除此之外,爲了評估Zn//MnO2電池的長期體內免疫記憶效應,通過第二次暴露於4T1-Luc細胞建立了腫瘤轉移模型,DB組是促進免疫記憶和對抗肺部腫瘤轉移的最有效治療方法。
圖4. 電池介導的多機制免疫激活。
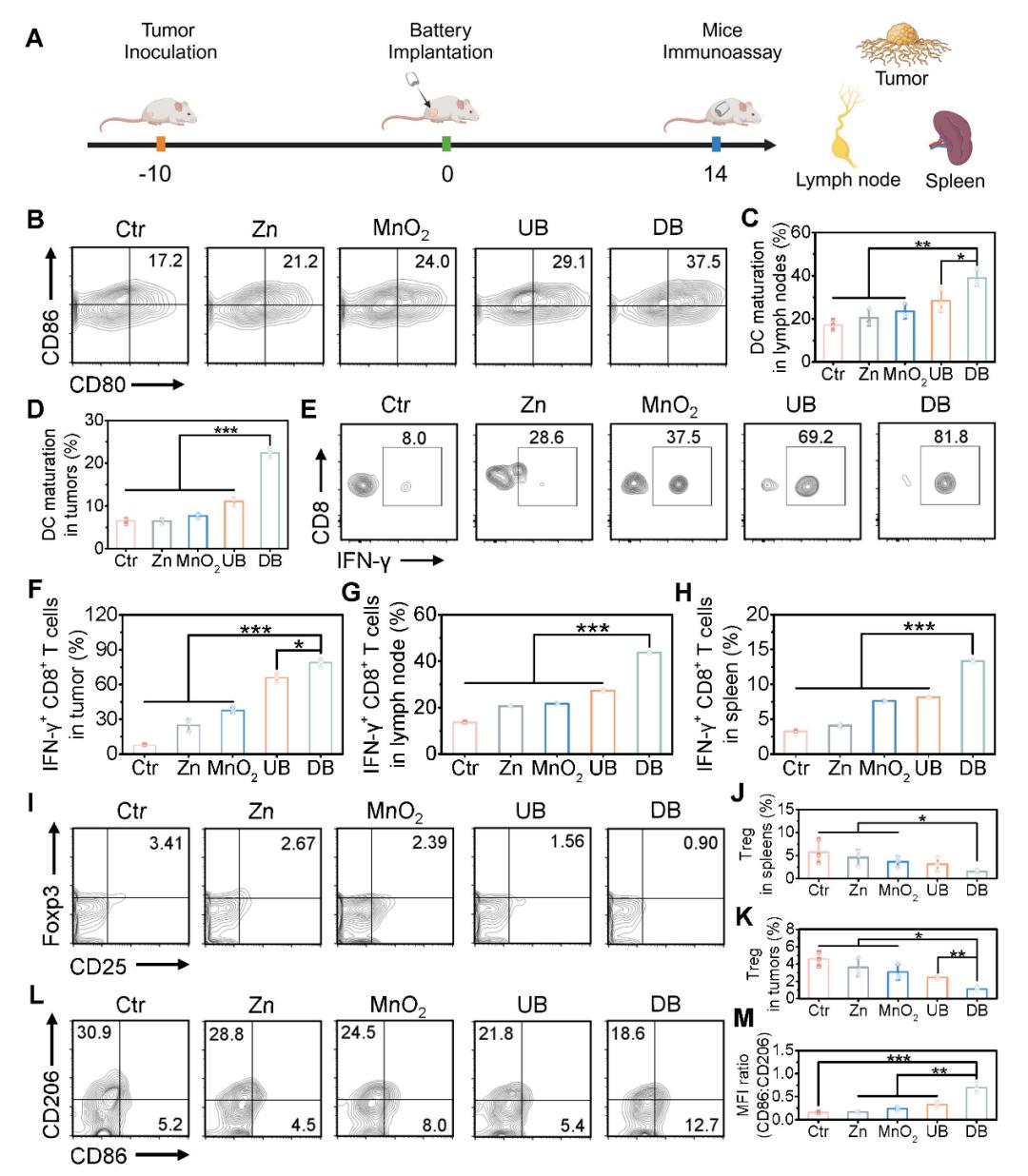
(A)電池介導的免疫測定示意圖。淋巴結中成熟DC的(B)FCM分析和(C)對應定量。(D)腫瘤中DC成熟的量化。(E)流式細胞術檢測腫瘤內CD8+T細胞中IFN-γ+的表達。(F)腫瘤、(G)淋巴結和(H)脾臟內CD8+T細胞中IFN-γ+的統計分析。脾臟Treg細胞的(I)FCM分析和(J)對應定量。(K)腫瘤中Treg細胞的定量分析。(L)腫瘤組織中促炎M1表型巨噬細胞和促腫瘤M2表型巨噬細胞的FCM分析。(M)M1型/M2型巨噬細胞比率的定量分析。
淋巴結(LN)和脾臟是最重要的免疫組織和器官,含有大量淋巴細胞,是人體免疫的中心。此外,腫瘤引流淋巴結(TDLN)是TAA通過淋巴管到達的第一個部位,被DC吸收,並被呈遞給T細胞進行適應性免疫反應以消除腫瘤細胞。因此,我們收集了小鼠的LN、脾臟和腫瘤來評估免疫相關指標的百分比。結果表明,首先,放電電池組(DB)組在體內有效地誘導了DC成熟,這有利於通過調節T細胞的增殖來啓動下游免疫反應;其次,在淋巴結、脾臟和腫瘤中引發了強烈的T細胞免疫反應;最後,由電池引起的緩解的免疫抑制增強了免疫細胞的殺傷作用。
【結論】
該研究團隊構築了一種可植入的Zn//MnO2電池,該電池利用腫瘤微環境流體作爲電解質,能夠延長放電時間,增加放電電流,並持續釋放Zn和Mn離子,用於無藥物的癌症免疫療法。這種局部電化學免疫治療策略通過在TME中啓動電池放電,允許在腫瘤細胞內持續輸送金屬離子。與其他治療方法相比,這種可植入電池可以降低全身毒性,並通過單次植入保持連續放電11天,從而提高患者的依從性,緩解與傳統可注射納米激動劑保留時間短相關的問題。電池放電產生Zn2+和Mn2+,以誘導ICD效應並在腫瘤細胞中釋放DAMPs。另一方面,Mn2+促進cGAS- STING通路的級聯激活,導致I-IFN和促炎細胞因子的分泌增加。這兩種機制共同促進了DC的成熟和T淋巴細胞的浸潤,增強了身體的免疫反應。此外,該電池通過降低Treg細胞水平和增加M1/M2巨噬細胞比率來逆轉腫瘤免疫抑制微環境。在上述綜合作用下,該電池在小鼠乳腺癌症模型中實現了99.6%的TGI率。其他涉及免疫相關生理或病理的疾病,如感染性、炎症性和自身免疫性疾病,也將受益於這種電池輸送系統。總體而言,這項工作表明,微環境激活電池有效地傳遞金屬離子並激活免疫反應,使其成爲一種有前景的治療設備。
【文獻鏈接】
文章題目:Tumor
microenvironment-activated Zn//MnO2 battery for sustained and local electrochemical immunotherapy
所有作者:Xiaoran Ding, Xiaoteng Jia*, Hongming Yuan, Daxin Pang, Hualu Zhao, Peng Sun, Fangmeng Liu, Danming Chao, Meiying Xin*, Caiyun Wang*, Geyu Lu, Gordon Wallace
期刊官方簡寫:Sci. Adv. 2025, 11, eadu1647, DOI: 10.1126/sciadv.adu1647
【團隊介紹】
近年來,盧革宇/賈曉騰團隊一直致力於生物電池治療領域的研究,已取得一系列成果(Nat. Commun., 2023, 14, 297;Sci. Adv.,2025, 11, eadu1647;Adv. Mater., 2024, 36, 2410205;ACS Nano, 2024, 18, 15681-15694;Chem. Sci., 2023, 14, 2123-2130)。該研究工作是團隊在植入式電池激活免疫治療腫瘤方面取得的新進展。
【相關工作展示】
1.Y. Zhou, X. T. Jia, D. X. Pang, S. Jiang, M. H. Zhu, G. Y. Lu, Y. P. Tian, C. Y. Wang, D. M. Chao, and G. Wallace, An integrated Mg battery-powered iontophoresis patch for efficient and controllable transdermal drug delivery. Nat. Commun., 2023, 14, 297. DOI: 10.1038/s41467-023-35990-7.
2.X. R. Ding, X. T. Jia, H. M. Yuan, D. X. Pang, H. L. Zhao, P. Sun, F. M. Liu, D. M. Chao, M. Y. Xin, C. Y. Wang, G. Y. Lu, and G. Wallace, Tumor microenvironment-activated Zn//MnO2 battery for sustained and local electrochemical immunotherapy. Sci. Adv., 2025, 11, eadu1647. DOI: 10.1126/sciadv.adu1647.
3.X. N. Ma, Y. Zhou, M. Y. Xin, H. M. Yuan, D. M. Chao, F. M. Liu, X. T. Jia, P. Sun, C. Y. Wang, G. Y. Lu, and G. Wallace, A Mg battery-integrated bioelectronic patch provides efficient electrochemical stimulations for wound healing. Adv. Mater., 2024, 36, 2410205. DOI: 10.1002/adma.202410205.
4.Y. Zhou, X. N. Ma, C. C. Yu, Y. P. Tian, Q. Liang, M. Y. Xin, P. Sun, F. M. Liu, D. M. Chao, X. T. Jia, A wearable self-charging electroceutical device for bacteria-infected wound healing. ACS Nano, 2024, 18, 15681-15694. DOI: 10.1021/acsnano.4c01818.
5.X. T. Jia, X. N. Ma, L. Zhao, M. Y. Xin, Y. L. Hao, P. Sun, C.G. Wang, D.M. Chao, F.M. Liu, C. Y. Wang, A biocompatible and fully erodible conducting polymer enables implanted rechargeable Zn batteries. Chem. Sci., 2023, 14, 2123-2130. DOI: 10.1039/d2sc06342e.