本文是專業學術論文解讀,不做醫療建議。
自 1790 年愛德華·詹納(Edward Jenner)發明牛痘疫苗以來,“抗原特異性”便成了疫苗學的金科玉律。簡單來說,就是一種疫苗預防一種疾病,通過模仿特定病毒的部分特徵——比如新冠病毒的刺突蛋白——來教導免疫系統識別敵人。
然而,當病原體變異或新病毒出現時,傳統疫苗往往失效,這也是爲什麼每年都要接種新的新冠加強針和流感疫苗的原因。更嚴峻的是,呼吸道威脅並非單一存在,病毒、細菌感染與過敏性疾病常相互疊加,進一步加劇防控難度。因此,開發一種針對多種病毒和細菌、具有廣泛保護性且臨牀適用的疫苗,以增強大流行應對能力並加強全球衛生安全,成爲疫苗學領域的重要課題。
近日,由斯坦福大學病理學、微生物學和免疫學教授巴利·普倫德蘭(Bali Pulendran)領導的研究團隊在 Science 發表研究成果,他們開發出一種通用候選疫苗,小鼠實驗表明該疫苗能夠預防多種呼吸道病毒、細菌甚至過敏原。與目前使用的任何疫苗不同,這種通過鼻內給藥的新型疫苗能提供長達數月的廣泛保護。
普倫德蘭是全球知名免疫學家和疫苗專家,專注於先天免疫如何調控適應性免疫,以及系統生物學在疫苗設計中的應用。他開創了“整合器官免疫”(integrated organ immunity)概念,正是這篇論文的核心機制。他領導過多項 NIH 和蓋茨基金會資助的項目。

圖 | 巴利·普倫德蘭(來源:斯坦福大學官網)
爲了彌補現有疫苗方案的侷限性,普倫德蘭團隊採取了完全不同的策略:疫苗不再模仿病原體,而是模仿免疫細胞在感染時相互交流的信號。這種新穎的策略整合了免疫系統的兩個分支:先天性免疫和適應性免疫,創造了一個維持廣泛免疫反應的反饋迴路。
先天性免疫是生物體與生俱來的、立即啓動的防禦機制,是免疫系統的第一道防線,反應速度迅速但持續時間短暫。適應性免疫是後天接觸病原體後發展起來的高度特異性防禦機制,是免疫系統的“精銳部隊”,其反應速度較慢,但可維持數年甚至終身。
長期以來有跡象表明,在某些情況下先天免疫可以持續更長時間。研究最深入的例子是卡介苗(BCG)結核病疫苗,每年有約 1 億新生兒接種該疫苗。流行病學和臨牀研究表明,它可以降低由其他感染引起的嬰兒死亡率,這表明這種交叉保護作用可以持續數月。但這種現象並不穩定,其機制也一直是個謎。
2023 年,普倫德蘭的團隊在小鼠研究中闡明瞭這一機制。與其他疫苗一樣,結核病疫苗在小鼠體內誘導了先天和適應性免疫反應,但不同尋常的是,其先天反應持續了幾個月。
研究人員發現,作爲適應性反應的一部分,被招募到肺部的 T 細胞正在向先天免疫細胞發送信號,以保持它們的活性。“那些 T 細胞提供了關鍵信號來維持先天系統的激活。先天系統通常持續幾天或一週,但在這種情況下,它可以持續三個月。”普倫德蘭指出。
研究人員表明,只要先天反應保持活躍,小鼠就能免受新冠病毒(SARS-CoV-2)和其他冠狀病毒的感染。他們確認 T 細胞發送的信號是激活先天免疫細胞上被稱爲 Toll 樣受體(TLR)的病原體傳感受體的細胞因子。
基於這一發現,研究團隊在隨後兩年多時間裏致力於開發包含 Toll 樣受體刺激物的疫苗。這種代號爲 GLA-3M-052-LS+OVA 的新疫苗,採用“佐劑+抗原”的組合:佐劑 GLA-3M-052-LS 包含兩種強效的 Toll 樣受體(TLR4 和 TLR7/8)激動劑,能同時激活呼吸道的先天免疫系統,讓免疫哨兵進入 “警戒狀態”;抗原卵清蛋白(OVA)則用來誘導免疫系統產生記憶 T 細胞,讓免疫部隊學會識別異物並快速反應,且該抗原無致病性,安全性更高。
在針對小鼠的實驗中,這種通用疫苗展現出了前所未有的防護廣度與持久性。
僅需三到四劑鼻內給藥,小鼠在長達至少三個月的時間裏,能夠抵禦包括 SARS-CoV-2 及其變異株、SARS 病毒以及多種蝙蝠來源的類 SARS 冠狀病毒(如 SCH014)的攻擊。接種疫苗的小鼠肺部病毒載量大幅下降,體重損失顯著減少,存活率達到 100%,且肺部炎症與肺泡損傷程度明顯減輕。
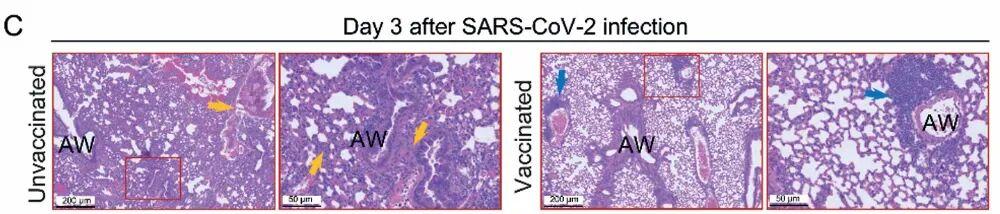
(來源:上述論文)
除了病毒,對金黃色葡萄球菌、鮑曼不動桿菌等常見且危險的醫院獲得性感染細菌,疫苗同樣表現出持久防禦力。實驗顯示,接種後 3 個月,小鼠肺部細菌載量下降 5-10 倍,有效降低了細菌感染引發的組織損傷。
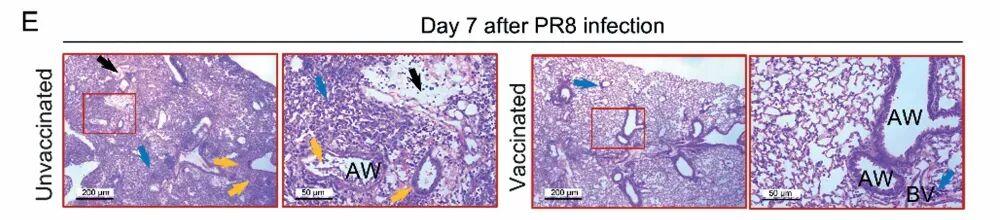
圖 | 在接種疫苗後 21 天、42 天及 3 個月,感染金黃色葡萄球菌後的肺部細菌載量(來源:上述論文)
最令人驚喜的是,該疫苗還能通過調節免疫平衡,抑制由屋塵蟎(HDM)誘導的 Th2 型炎症反應,從而有效預防過敏性哮喘。接種疫苗的小鼠氣道嗜酸性粒細胞與 ILC2 細胞浸潤減少,Th2 細胞分泌的 IL4、IL5、IL13 等炎症因子水平降低,血清 IgE 濃度下降,氣道保持暢通,未出現未接種組常見的粘液過度分泌現象,且這種保護效果持續至少三個月。
深入機制研究表明,疫苗的廣譜防護效應源於其誘導的 “整合器官免疫”:一方面,疫苗激發產生的抗原特異性 CD4+ 和 CD8+ 組織駐留記憶 T 細胞(TRM)長期駐紮肺部,通過表觀遺傳重編程改造肺泡巨噬細胞(AMs),增強其抗原呈遞、吞噬病原體及抗病毒能力;另一方面,感染後肺部會快速形成三級淋巴結構(TLS),加速免疫細胞聚集與協同反應,同時限制過度炎症(如細胞因子風暴),實現快速清除病原體以及減少組織損傷的雙重目標。
目前,研究團隊計劃下一步推進人類臨牀試驗:首先開展 I 期安全性試驗,驗證鼻內給藥的耐受性與安全性;若進展順利,將啓動更大規模的臨牀試驗,評估疫苗在人類中的防護效果。Pulendran 表示,基於小鼠實驗數據,兩劑鼻噴霧劑有望在人類中提供有效保護,且鼻噴方式無需注射,依從性更高,尤其適合老人、兒童等易感人羣。
在最理想的情況下,若資金與臨牀試驗進展順利,這款通用呼吸道疫苗可能在 5-7 年內問世。
參考鏈接:
Haibo Zhang et al, Mucosal vaccination in mice provides protection from diverse respiratory threats, Science (2026). DOI: 10.1126/science.aea1260.
https://med.stanford.edu/pulendranlab.html